


目前,人们越来越意识到高胆固醇饮食(HCD)的危害,因为它可能导致肥胖、高脂血症和其他健康问题。其中,高脂血症会增加脂肪肝、高血压、动脉粥样硬化、血栓形成和脑血管疾病的风险。有研究表明,中医药中的丹参(Radix Salvia Miltiorrhizae)和红花(Flos Carthami)对高脂血症有良好的疗效。已有研究证明,丹参中的Protocatechualdehyde(PCA)可以保护心血管系统免受氧化应激和动脉粥样硬化的影响,并减少心脏肥大,而作为红花的成分,hydroxysafflor yellow A(HSYA)可以降低血脂水平,调节血管收缩,维持舒张功能,两者都已被证明可以预防和治疗动脉粥样硬化。
在过往的研究中,斑马鱼是研究脂质代谢的热门动物,例如脂肪肝、高脂血症、糖尿病等。它具有体积小和光学透明的优点,可用于评估体内药物的疗效和毒性,并且鱼类和哺乳动物在脂质代谢方面存在许多相似之处。本文的研究使用高胆固醇饮食(HCD)喂养的斑马鱼作为高脂血症模型,探讨了PCA、HSYA和PCA+HSYA对高脂血症引起的问题和肝功能损伤的影响。
对野生型(AB)斑马鱼进行每天两次喂食,对照组进行普通饲料喂养,高胆固醇饮食组进行高胆固醇饮食喂养。对斑马鱼幼鱼进行毒性评估,并测定和高血脂相关的甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)的检测,以及斑马鱼幼鱼行为学分析、血流动力学分析等其他相关测试(本文仅介绍部分研究内容,想阅读完整内容,欢迎查看原文)。
在行为学分析中,每个实验组对幼鱼使用斑马鱼行为轨迹跟踪系统(DanioVision)进行分析。将斑马鱼幼鱼分别放置在DanioVision的96孔板中,使其适应环境,然后开始记录1小时的行为。使用动物运动轨迹跟踪系统(EthoVision XT)分析和处理视频,并量化一小时内的总移动距离和平均速度。
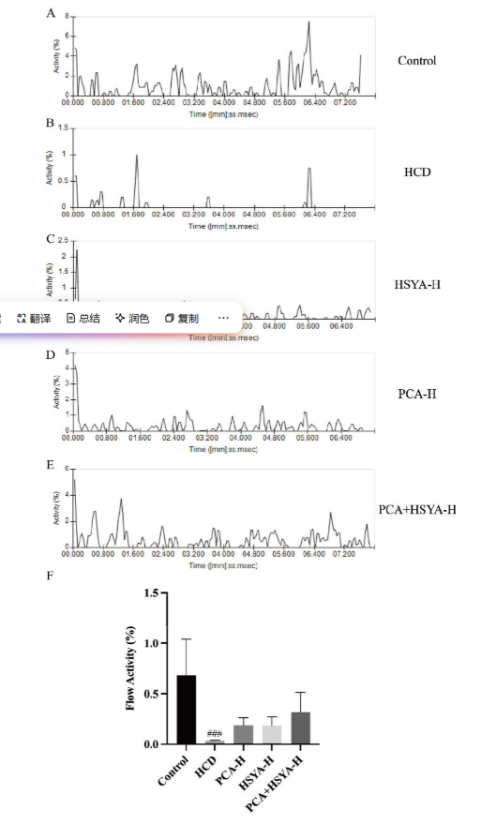
在血流动力学分析中,在以HCD喂养并暴露于PCA、HSYA和PCA +HSYA后,对斑马鱼幼鱼进行视频记录,以评估血流。通过斑马鱼微视行为分析系统(DanioScope)分析视频标记区域中红细胞的运动来评估血流活动,并将结果进行比较。
经过48小时的高胆固醇饮食(HCD)处理后,斑马鱼幼鱼HCD组的总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和甘油三酯(TG)水平显著高于对照组,而高密度脂蛋白胆固醇(HDL-C)值则显著降低(图1)。与HCD组相比,经过48小时的PCA和HSYA处理后,TC、LDL-C和TG显著降低,但HDL-C升高,且联合使用效果优于单独使用。这表明PCA、HSYA和PCA + HSYA对高脂血症斑马鱼具有有效的降脂作用,且呈剂量依赖性。
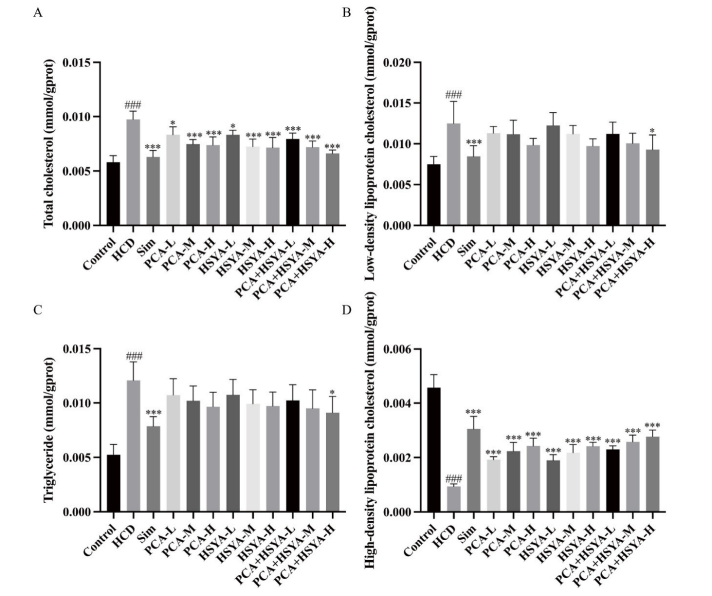
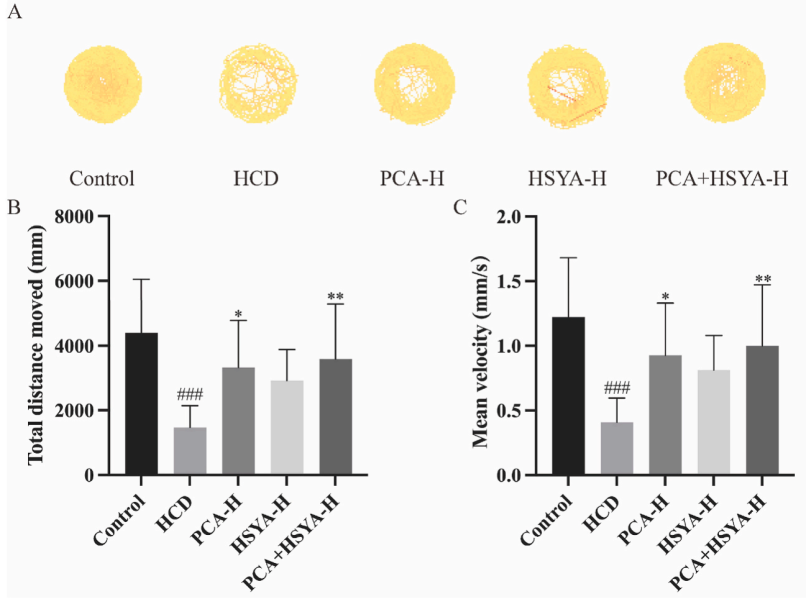
图2A显示了斑马鱼幼鱼的运动轨迹。对照组斑马鱼幼鱼的总移动距离和平均速度大于HCD处理组幼鱼的总移动距离和平均速度,表明运动距离和速度受到HCD喂养的影响;喂食HCD并补充PCA、HSYA和PCA + HSYA处理的幼鱼的总移动距离和平均速度如图2B–C所示。
研究进一步评估了PCA和HSYA对斑马鱼血液动力学的影响。如图3所示,与对照组相比,HCD斑马鱼幼鱼的血流活动显著降低;当给予PCA、HSYA和PCA + HSYA时,血流活动增加,且PCA +HSYA的效果优于单独使用。结果表明,PCA +HSYA可以改善斑马鱼的血液高凝状态。
为了进一步研究HCD饮食对斑马鱼幼鱼肝脏脂肪变性的影响以及PCA和HSYA的改善作用,研究对肝脏组织进行了组织病理学观察。组织病理学结果表明,对照组的肝脏组织完整。然而,在HCD饮食组和辛伐他汀组(Sim)中,肝脏组织中出现了大量空泡,肝细胞变形且排列不规则。相比之下,PCA、HSYA及其联合用药可改善斑马鱼幼鱼的肝脏脂肪变性并恢复肝脏组织结构,特别是在PCA + HSYA-H组中(图4)。这表明辛伐他汀(Sim)对改善肝功能没有明显效果,而PCA和HSYA对改善肝功能有明显效果。
高脂血症是最常见的血脂水平异常疾病之一,也是导致心血管疾病发生的主要危险因素之一,可导致动脉粥样硬化。在本研究中,建立了HCD喂养的高脂血症斑马鱼模型,斑马鱼在研究脂质代谢和脂质异常方面的优势在于其光学透明性。PCA和HSYA分别是丹参和红花的活性成分,在高脂血症模型中,PCA、HSYA和PCA + HSYA对高脂血症斑马鱼具有有效的降脂作用,且呈现剂量依赖性。并且,PCA +HSYA可以改善斑马鱼的血液高凝状态,同时PCA和HSYA对改善肝功能有明显效果。这些结果可能为研究PCA和HSYA改善高脂血症的治疗机制以及为未来高脂血症的临床应用开发相关药物提供新的思路。
Lin, Bingying, et al. “Lipid regulation of protocatechualdehyde and hydroxysafflor yellow A via AMPK/SREBP2/PCSK9/LDLR signaling pathway in hyperlipidemic zebrafish.” Heliyon 10.3 (2024).
